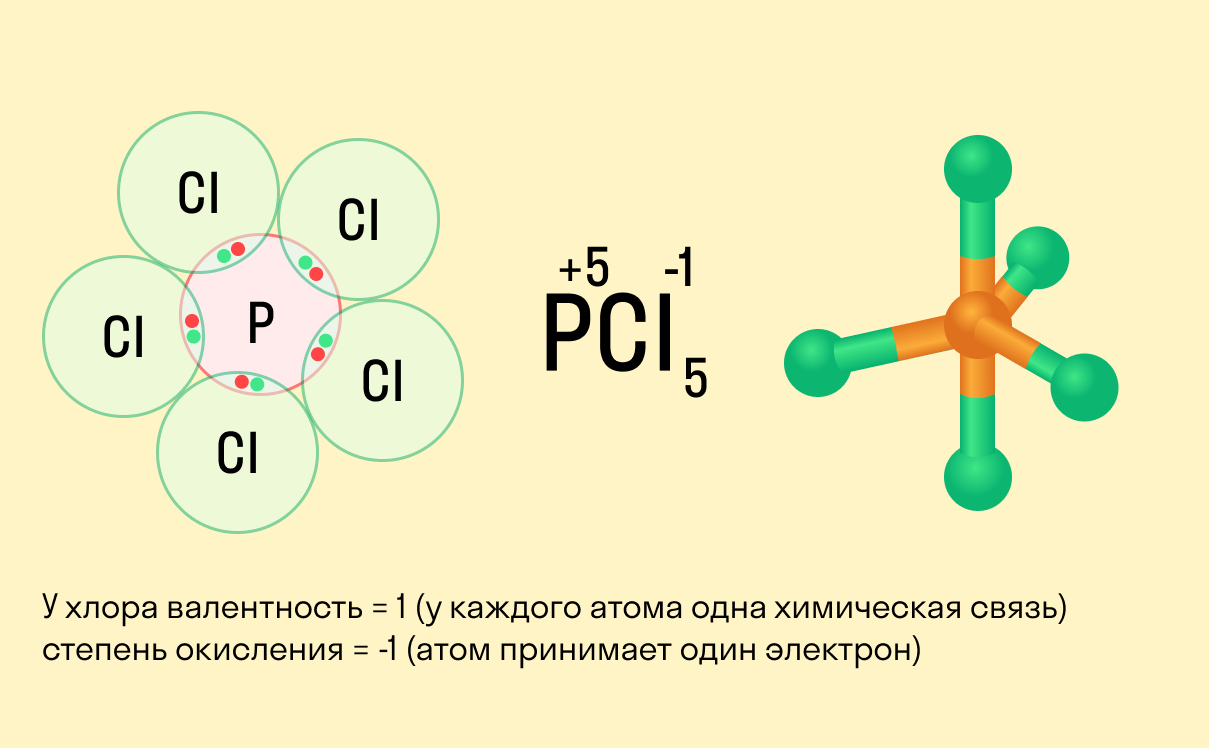
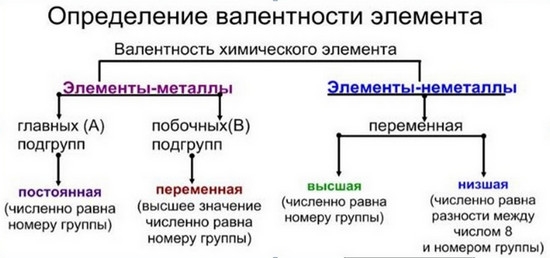
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов.
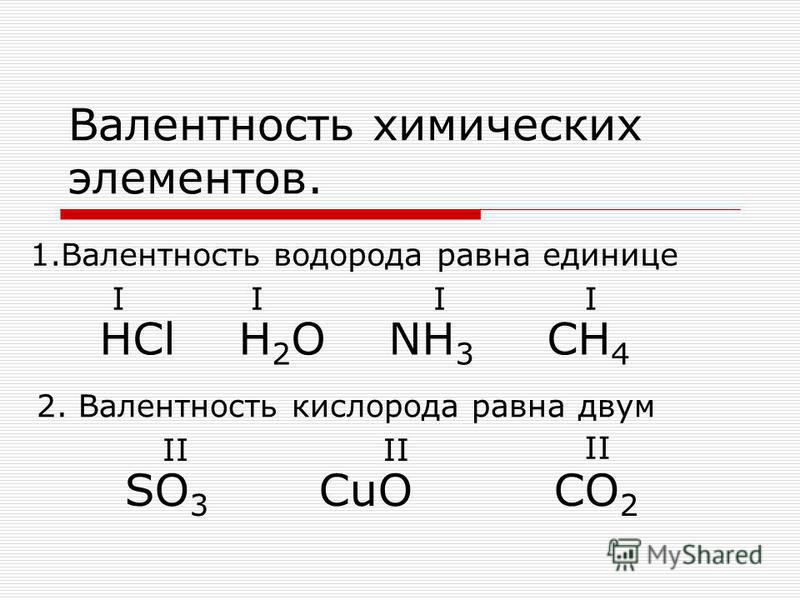
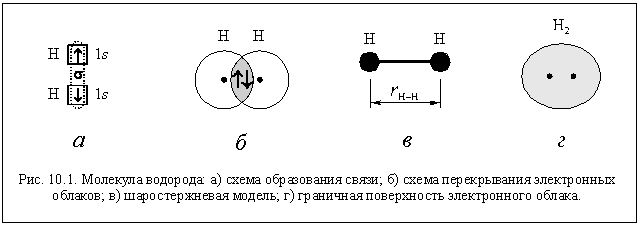
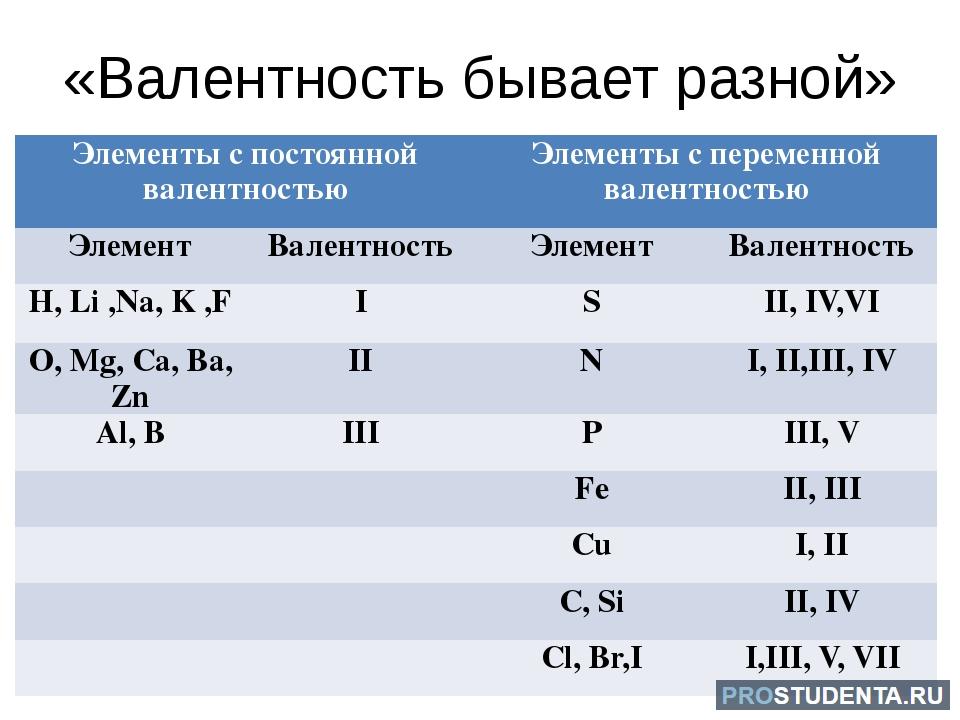
Мы уже говорили , что термин валентность допустимо применять только к атомам, которые связаны с другими атомами ковалентными химическими связями. Так как по определению, валентность - это количество ковалентных связей конкретного атома. Во многих школьных учебниках и пособиях учат составлять формулы по валентностям, даже для соединений с ионными связями. Для упрощения процедуры составления формул это, на наш взгляд, допустимо. Но нужно понимать, что это не совсем корректно ввиду вышеизложенной причины.
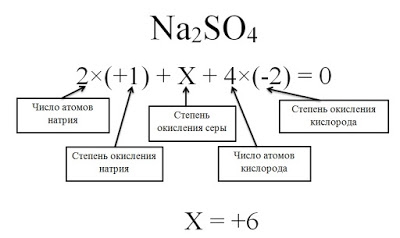



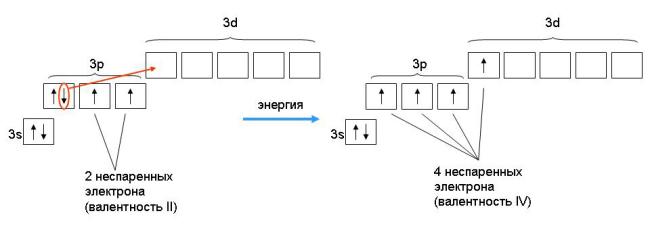




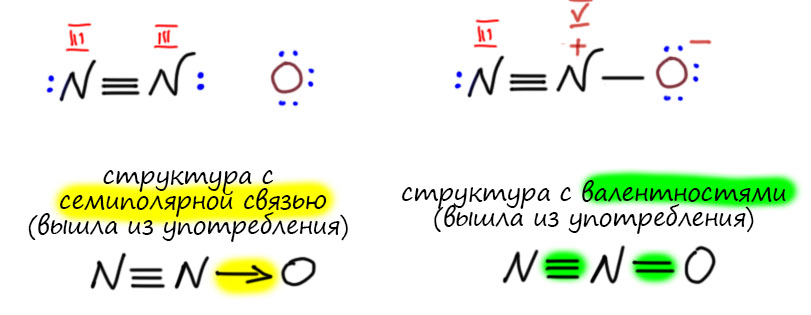
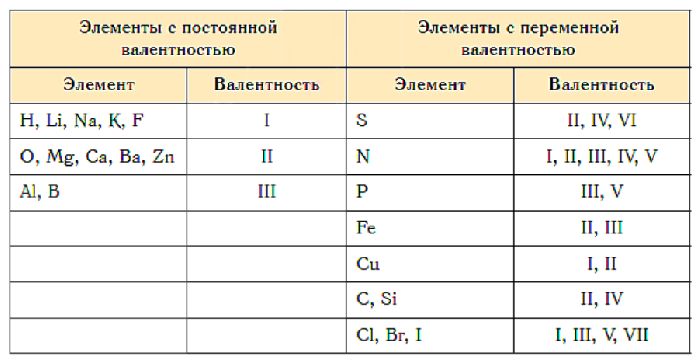
У элементов различают высшую и низшую степени окисления. Высшая степень окисления, как правило, равна номеру группы искл. F, O, N. Низшая степень окисления неметаллов равна разности между 8 и номером группы равна числу недостающих до октета электронов. Атомы металлов не проявляют отрицательных степеней окисления, так как никогда не притягивают электроны от других атомов, для них низшая степень окисления равна 0.
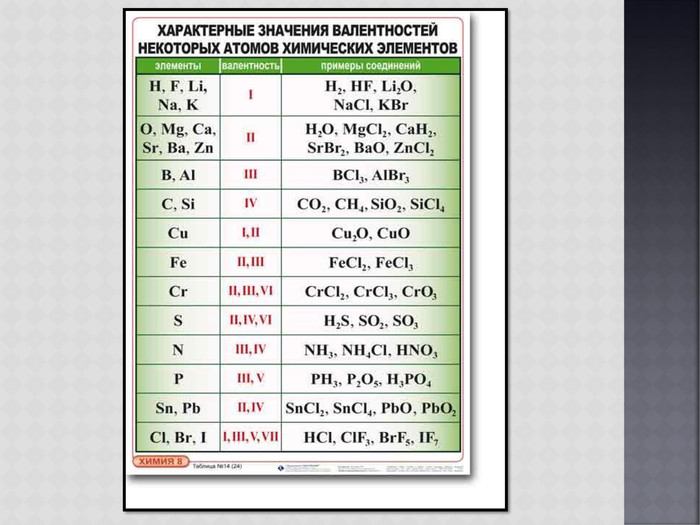
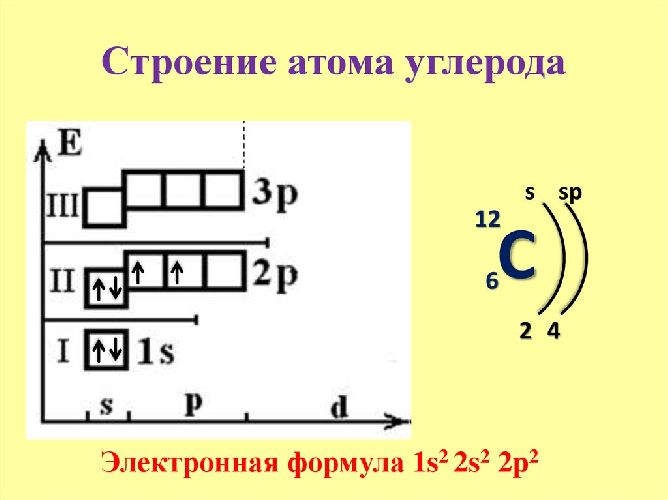
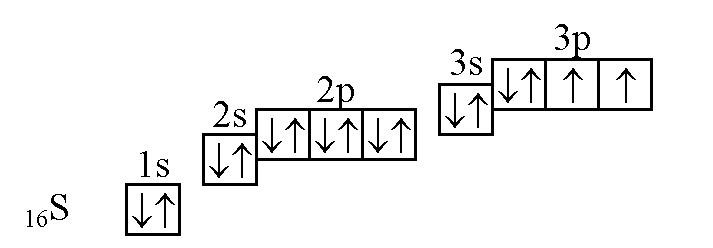
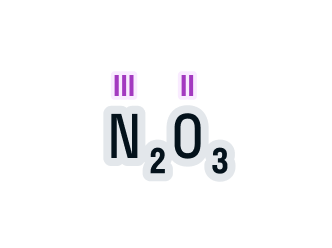



Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов. Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:. График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.